PERIODONCIA, BOCA COVID, CLINICA DENTAL VALLADOLID

ÍNDICE
Introducción y objetivo
Conexión boca-COVID como origen de complicaciones sistémicas
Conexión boca-COVID como origen directo
Manifestaciones orales de la COVID-19
La boca: test y vacunas
Introducción
Se sabe que el coronavirus SARS-CoV-2, responsable de la pandemia COVID-19, puede
ingresar en nuestro organismo a través de las mucosas oral, nasal u ocular. El contagio es
posible mediante contacto directo (mano contaminada que llevamos a la mucosa de la boca,
nariz u ojos) o por vía respiratoria (gotitas o aerosoles que ingresan directamente desde una
persona infectada).
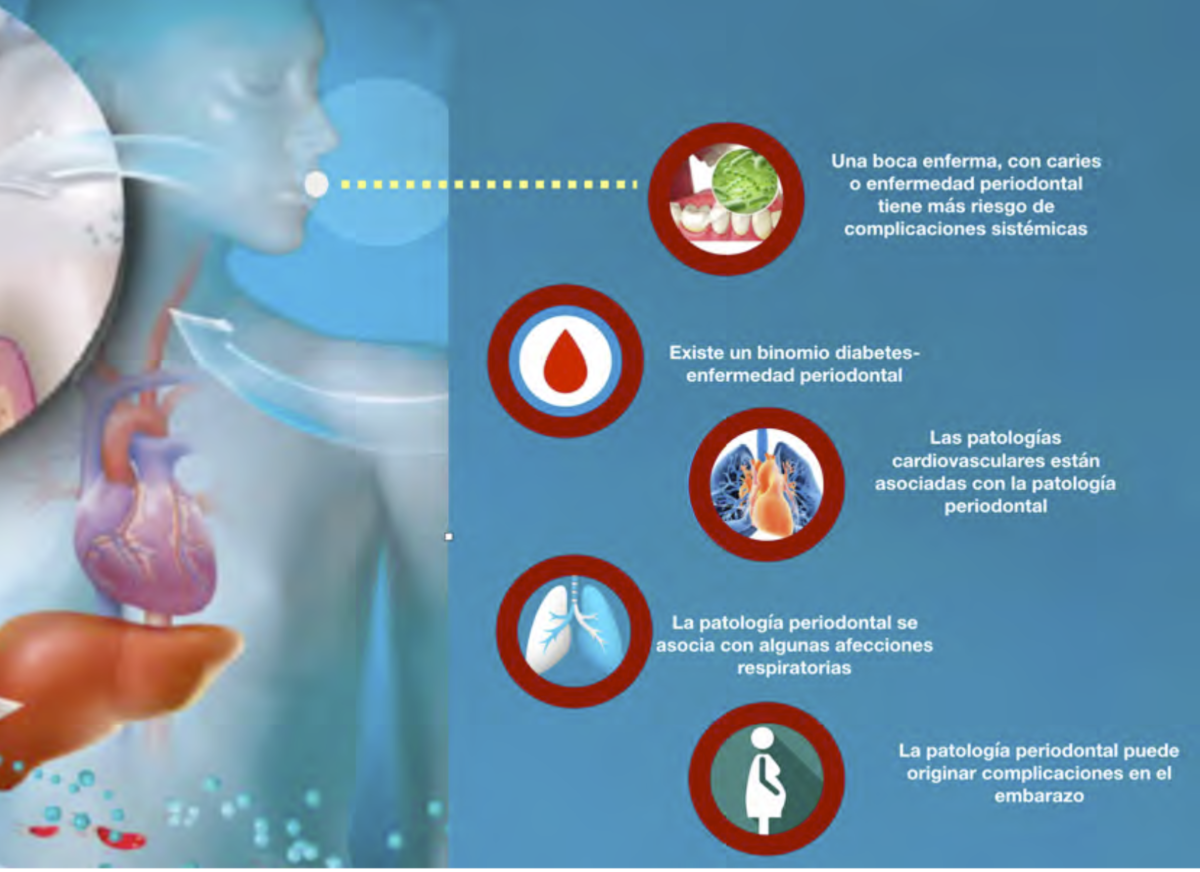
Está ampliamente documentada la relación entre la presencia de patologías previas y la
evolución pronostica de la COVID-19, en caso de contraerse. Una pobre salud oral incrementa el
riesgo de enfermedades sistémicas, pudiendo originar complicaciones cardiacas, pulmonares,
problemas en el embarazo o empeorar una diabetes, todas ellas asociadas con un peor
pronóstico y evolución de la COVID-19.
A esta conexión boca-COVID que podemos denominar “indirecta” se han venido a sumar
en estos últimos meses, varios estudios que apuntan a una posible asociación directa.
En este Documento técnico informativo se aportan los datos más actualizados de ambos
mecanismos asociativos, el indirecto y el directo. Una vez más, y como viene siendo habitual en
este tipo de documentos técnicos elaborados por el Consejo General, subrayar la provisionalidad
y prudencia requerida en la interpretación de los datos, dado el carácter evolutivo del conocimiento que se tiene sobre la COVID-19 y la ingente información que periódicamente se va generando en el ámbito de la investigación internacional.
3
Objetivo del documento
Analizar la evidencia científica disponible en este Consejo General sobre la conexión boca-
COVID-19.
CONEXIÓN BOCA-COVID CÓMO ORIGEN DE
COMPLICACIONES SISTÉMICAS
Hipótesis: una boca enferma presenta mayor riesgo de desarrollar complicaciones sistémicas.
Análisis indirecto: la presencia de patologías sistémicas previas va asociada a un riesgo muy
superior de evolución desfavorable en caso de presentar COVID-19.
Desarrollo
El nuevo coronavirus SARS-CoV-2 se detectó por primera vez a finales de 2019 y se ha
convertido rápidamente en una pandemia mundial. La edad es uno de los factores de riesgo más
importantes para desarrollar síntomas severos de COVID-191. Por lo tanto, las personas
mayores de 65 años y las que viven institucionalizadas son especialmente vulnerables a la
morbilidad y la mortalidad debido a la infección por el SARS-CoV-2. Asimismo, las personas con
enfermedad pulmonar crónica, asma moderada a grave, obesidad grave, diabetes, enfermedad
renal crónica y enfermedad hepática también tienen un alto riesgo de presentar síntomas graves
de COVID-19. Un estudio enumera a la hipertensión, la obesidad y la diabetes como las tres
principales afecciones subyacentes, con los resultados más desfavorables en los pacientes con
COVID-19 que requieren hospitalización2. Si bien la COVID-19 puede afectar múltiples órganos,
incluidos riñones e hígado, la principal causa de mortalidad se debe a la capacidad del SARS-
CoV-2 de infectar el tracto respiratorio, provocando una neumonía grave3. Una característica de
la COVID-19 es su capacidad para desencadenar una reacción inmune excesiva en el huésped,
denominada “tormenta de citoquinas”, que causa un daño tisular extenso, particularmente en el
tejido conectivo de los pulmones4. La patología pulmonar de los pacientes que mueren por
neumonía COVID-19 incluye edema, hiperplasia reactiva focal de neumocitos con infiltración
celular inflamatoria y células gigantes multinucleadas5.
En los últimos años, ha quedado claro que la salud bucal tiene un gran impacto en la
salud general. Varios estudios sugieren que las citoquinas o productos microbianos liberados
sistémicamente en respuesta a una infección oral, provocan inflamación en órganos distantes, lo
que favorece el desarrollo de enfermedades sistémicas como la enfermedad de Alzheimer,
1 Zhou F., Yu T., Du R., Fan G., Liu Y., Liu Z. Clinical course and risk factors for mortality of adult
inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;
395:1054–1062.
2 Richardson S., Hirsch J.S., Narasimhan M., Crawford J.M., McGinn T., Davidson K.W. Presenting
characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19
in the New York city area. JAMA. 2020; 323:2052–2059.
3 Chen J. Pathogenicity and transmissibility of 2019-nCoV-A quick overview and comparison
with other emerging viruses. Microb Infect. 2020; 22:69–71
4 Pedersen S.F., Ho Y.C. SARS-CoV-2: a storm is raging. J Clin Invest. 2020; 130:2202–2205.
5 Tian S., Hu W., Niu L., Liu H., Xu H., Xiao S.Y. Pulmonary pathology of early-phase 2019 novel
coronavirus (COVID-19) pneumonia in two patients with lung cancer. J Thorac
Oncol. 2020;15:700–704
4

diabetes, cardiopatía aterosclerótica y enfermedad cerebrovascular entre otras 6,7,8,9. La investigación también ha demostrado que una
mala salud bucal puede empeorar las complicaciones de enfermedades
sistémicas como la diabetes, la enfermedad renal crónica y la
enfermedad hepática10.
Además, la cavidad bucal es un importante reservorio de patógenos respiratorios, como
la Chlamydia pneumoniae; y los pacientes con enfermedad periodontal tienen más
probabilidades de desarrollar neumonía adquirida hospitalaria como complicación11. Varios
mecanismos han sido explorados para explicar la capacidad de los patógenos orales para
exacerbar la infección pulmonar, incluida la aspiración de patógenos orales al tracto respiratorio
inferior, especialmente en personas de alto riesgo; modificación de las superficies mucosas a lo
largo del tracto respiratorio por enzimas salivales, lo que facilita la colonización por patógenos;
y secreción de citoquinas proinflamatorias durante la periodontitis, que pueden promover la
adhesión al epitelio pulmonar y la colonización pulmonar por patógenos respiratorios12. Por lo
tanto, mejorar la higiene bucal puede reducir la colonización orofaríngea y el riesgo de
complicaciones respiratorias13.
También se ha demostrado que la mejora de la higiene bucal y el cuidado profesional
frecuente de la salud bucal reducen la progresión o la aparición de enfermedades respiratorias,
especialmente en la población anciana y en las unidades de cuidados intensivos14. Esta
población también tiene un mayor riesgo de desarrollar complicaciones graves relacionadas con
COVID-19 15.
6 Bui F.Q., Almeida-da-Silva C.L.C., Huynh B., Trinh A., Liu J., Woodward J. Association between
periodontal pathogens and systemic disease. Biomed J. 2019; 42:27–35.
7 Wu Z., Nakanishi H. Connection between periodontitis and Alzheimer’s disease: possible roles
of microglia and leptomeningeal cells. J Pharmacol Sci. 2014; 126:8–13.
8 Jepsen S., Stadlinger B., Terheyden H., Sanz M. Science transfer: oral health and general health
– the links between periodontitis, atherosclerosis and diabetes. J Clin Periodontol. 2015;
42:1071–1073.
9 Khumaedi A.I., Purnamasari D., Wijaya I.P., Soeroso Y. The relationship of diabetes,
periodontitis and cardiovascular disease. Diabetes Metab Syndr. 2019; 13:1675–1678.
10 Han P., Sun D., Yang J. Interaction between periodontitis and liver diseases. Biomed
Rep. 2016; 5:267–276.
11 Almeida-da-Silva C.L.C., Alpagot T., Zhu Y., Lee S.S., Roberts B.P., Hung S.C. Chlamydia
pneumoniae is present in the dental plaque of periodontitis patients and stimulates an
inflammatory response in gingival epithelial cells. Microb Cell. 2019; 6:197–208.
12 Varanat M., Haase E.M., Kay J.G., Scannapieco F.A. Activation of the TREM-1 pathway in
human monocytes by periodontal pathogens and oral commensal bacteria. Molecular oral
microbiology. 2017; 32:275–287.
13 Botros N, Iyer P, Ojcius DM. Is there an association between oral health and severity of COVID-
19 complications? Biomed J. 2020;43(4):325-327. doi:10.1016/j.bj.2020.05.016
14 Azarpazhooh A., Leake J.L. Systematic review of the association between respiratory diseases
and oral health. J Periodontol. 2006; 77: 1465–1482.
15 Boccardi V., Ruggiero C., Mecocci P. COVID-19: a geriatric emergency. Geriatrics. 2020; 5:24.
5
Esquema: Los mecanismos a través de los cuales una mala salud bucal puede exacerbar los
síntomas de la COVID-19. (Tomado de Botros N et al. Biomed J. 2020; 43:325-327).
LA EVIDENCIA CIENTÍFICA
Como se ha comentado, es muy abundante la evidencia científica que demuestra la
asociación entre una pobre salud oral y el riesgo de desarrollar complicaciones sistémicas. Sin
pretender ser exhaustivos (al no ser el objetivo central de este documento técnico) a
continuación se citan algunos estudios (revisiones sistemáticas, metaanálisis y documentos de
consenso) sobre algunas de ellas. En el presente Documento técnico se analizan las asociaciones
entre la enfermedad periodontal con la diabetes, enfermedades cardiovasculares, patologías
respiratorias y complicaciones potenciales del embarazo.
6
Enfermedad periodontal y diabetes


Anh Thi Mai Nguyen, Rahena Akhter, Siddharth Garde, Claire Scott, Stephen M. Twigg, Stephen
Colagiuri, Shilpi Ajwani, Joerg Eberhard, The association of periodontal disease with the
complications of diabetes mellitus. A systematic review, Diabetes Research and Clinical Practice,
2020; 165 (july) https://doi.org/10.1016/j.diabres.2020.108244
Enfermedad periodontal y cardiovasculares
Sanz M et al. Periodontitis and cardiovascular diseases: Consensus report. J Clin Periodontol.
2020 Mar;47(3):268-288. doi: 10.1111/jcpe.13189. Epub 2020 Feb 3. PMID: 32011025; PMCID:
PMC7027895.
7
Enfermedad periodontal y patología respiratoria

Gomes-Filho IS, Cruz SSD, Trindade SC, Passos-Soares JS, Carvalho-Filho PC, Figueiredo ACMG,
Lyrio AO, Hintz AM, Pereira MG, Scannapieco F. Periodontitis and respiratory diseases: A
systematic review with meta-analysis. Oral Dis. 2020 Mar;26(2):439-446. doi:
10.1111/odi.13228. Epub 2019 Nov 28. PMID: 31715080.
CONEXIÓN BOCA-COVID CÓMO ORIGEN DIRECTO
Hipótesis: existe asociación directa entre algunos biomarcadores inflamatorios periodontales y
la evolución de la COVID-19.
Análisis indirecto: la presencia de determinadas patologías orales tiene relación de manera
directa con algunos aspectos de la COVID-19.
Desarrollo
En estos últimos meses, además de considerar a la boca como factor potencial de riesgo
en la COVID-19, al estar avalada la conexión entre patología oral y desencadenamiento y/o
agravamiento de procesos sistémicos, también está generándose literatura científica que analiza
el potencial riesgo directo de una boca enferma en su relación a la COVID. Cómo veremos en
este apartado, son varios los estudios ya disponibles que explican esta posible asociación.
Es importante conocer los principales mecanismos de defensa existentes en la cavidad
oral16.
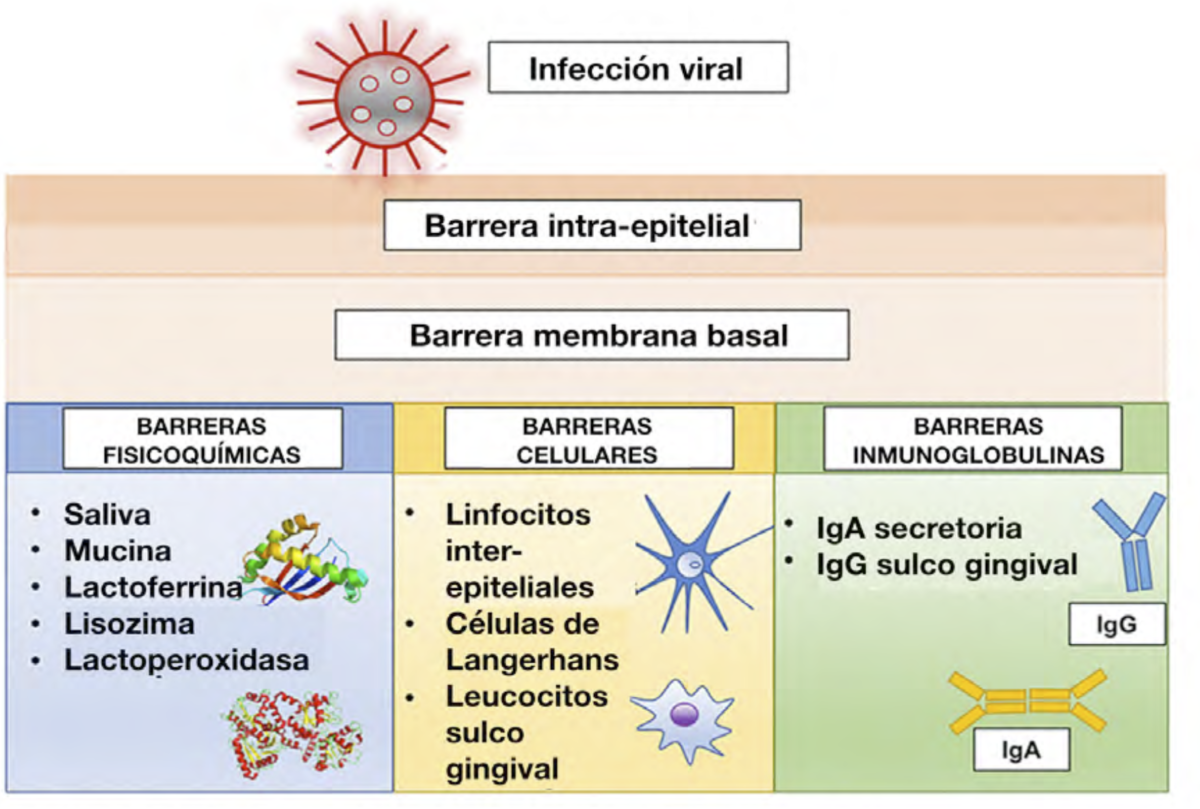
9
Figura: Principales mecanismos de defensa en la cavidad oral. Tomado de La Rosa Giusy
RM et al (cita 16).
El desarrollo y la gravedad de las complicaciones después de una infección por COVID-
19 dependen de numerosos factores virales y del huésped que afectarán a la respuesta
inmunitaria del paciente. Mientras que el 80% de los pacientes con infecciones por COVID-19
tienen síntomas leves, en torno al 20% progresa hacia una forma grave de infección, asociada
con niveles más altos de marcadores inflamatorios (interleucina 2, 6, 10)17,18. También exhiben
un notable mayor recuento de neutrófilos y menor recuento de linfocitos comparativamente a
los pacientes leves19. Las bacterias periodontógenas están implicadas en la inflamación
sistémica, la bacteriemia y la neumonía. Las bacterias presentes en el metagenoma de pacientes
gravemente infectados con COVID-19 incluyen lecturas altas de Prevotella, Staphylococcus y
Fusobacterium, todos ellos, organismos generalmente comensales de la boca20. Está claro que
las sobreinfecciones bacterianas son comunes en pacientes que padecen un caso grave de
COVID-1921. Por todo ello, se recomienda que la mala salud oral se considere un factor riesgo
para la COVID-19, particularmente en pacientes predispuestos a biofilms alterados debido a
diabetes, hipertensión o enfermedad cardiovascular22.
Son varias las razones biológicas para considerar a la periodontitis como un factor de
riesgo de enfermedades respiratorias y como tal, puede contribuir al desarrollo de
complicaciones respiratorias en pacientes con COVID-19. Se proponen varios mecanismos como
posibles explicaciones de la asociación entre el entorno oral y la salud pulmonar, incluida la
inflamación sistémica, la carga bacteriana y la función endotelial., entre otras. La capacidad del
tratamiento periodontal no quirúrgico para reducir los niveles de citoquinas está ampliamente
documentada en la literatura internacional 23,24. Lobäo y col25 encuentran una reducción
promedio de IL-6 de 12 ng/ml tres meses después del tratamiento periodontal convencional.
Por lo tanto, los niveles más bajos de IL-6 y de inflamación resultante del tratamiento
periodontal puede proteger potencialmente a los pacientes con COVID-1926. Los niveles altos de
17 Gong J. Correlation Analysis Between Disease Severity and Inflammation-related Parameters in
Patients with COVID-19 Pneumonia. Tongji Hospital, 2020.
18 Liu J. Neutrophil-to-Lymphocyte Ratio Predicts Severe Illness Patients with 2019 Novel
Coronavirus. Beijing Ditan Hospital, 2020.
19 Zheng M, Gao Y, Wang G et al. Functional exhaustion of antiviral lymphocytes in COVID-19
patients. Cell Moll Immunol 2020; DOI: 10.1038/s41423-020-0402-2.
20 Chakraborty S. Metagenome of SARS-Cov2 patients in Shenzhen with travel to Wuhan: OSF
Preprints, 2020.
21 Gautret P, Lagier J-C, Parola P et al. Hydroxychloroquine and azithromycin as a treatment of
COVID-19: Results of an Open-Label Non-randomized trial. Int J Antimicrob Agents2020; DOI:
10.1016/j.ijantimicag.2020.105949.
22 Sampson, V. Oral hygiene risk factor. Br Dent J 228, 569 (2020).
23 Reis C, et al. Clinical improvement following therapy for periodontitis: Association with a
decrease in IL-1 and IL-6. Exp Ther Med 2014;8(1):323–327. doi:10.3892/etm.2014.1724.
24 Zhou SY, Duan XQ, Hu R, Ouyang XY. Effect of nonsurgical periodontal therapy on serum
levels of TNF-a, IL-6 and C-reactive protein in periodontitis subjects with stable coronary heart
disease. Chin J Dent Res 2013;16(2):145–151.
25 Lobão WJM, et al. Relationship between periodontal outcomes and serum biomarkers
changes after nonsurgical periodontal therapy. An Acad Bras Cienc 2019;91(2):e20170652. doi:
10.1590/0001-3765201920170652.
26 Molayem S, Pontes CC. The Mouth-COVID Connection: Il-6 Levels in Periodontal Disease —
Potential Role in COVID-19-Related Respiratory Complications [published online ahead of print
July 30, 2020]. J Calif Dent Assoc doi: 10.35481/jcda-48-10-01.
10
IL-6 en suero pueden predecir las complicaciones respiratorias en pacientes con COVID-19 y ser
un marcador de la necesidad de ventilación mecánica27, por lo que los dentistas deben centrarse
en eliminar las afecciones subyacentes que promueven la inflamación sistémica, como la
periodontitis y otras afecciones bucales28.
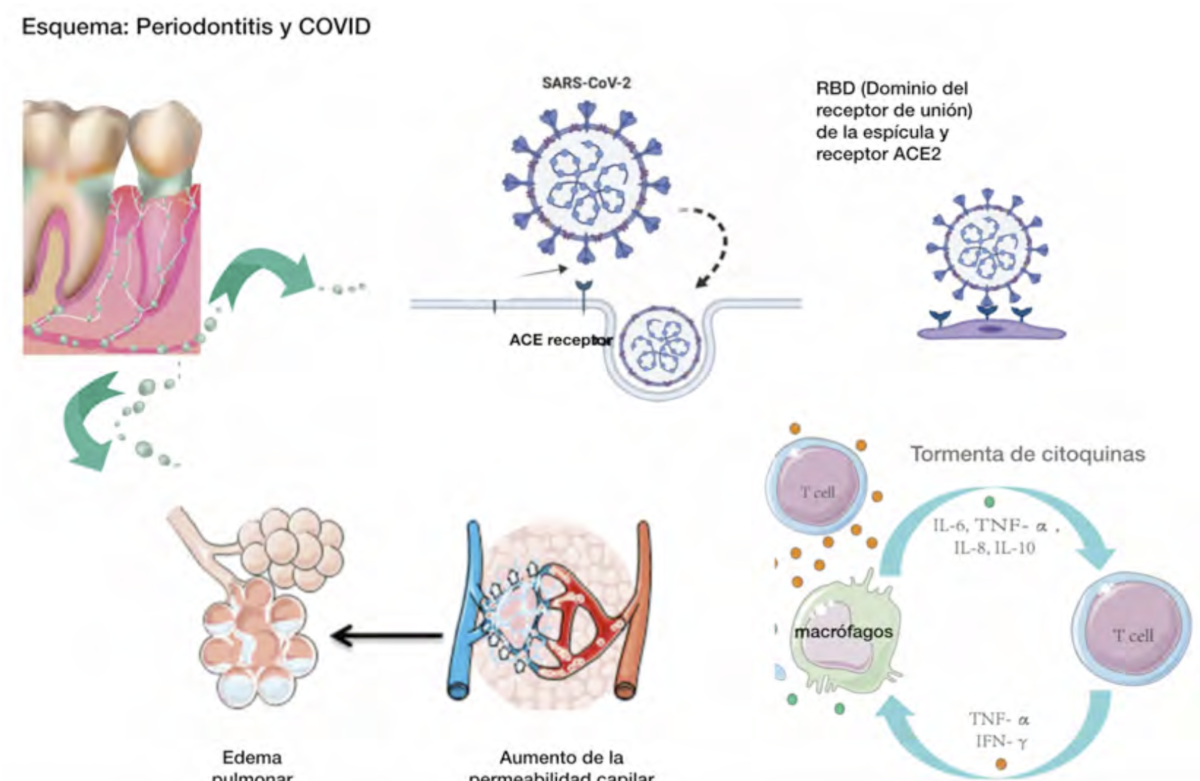
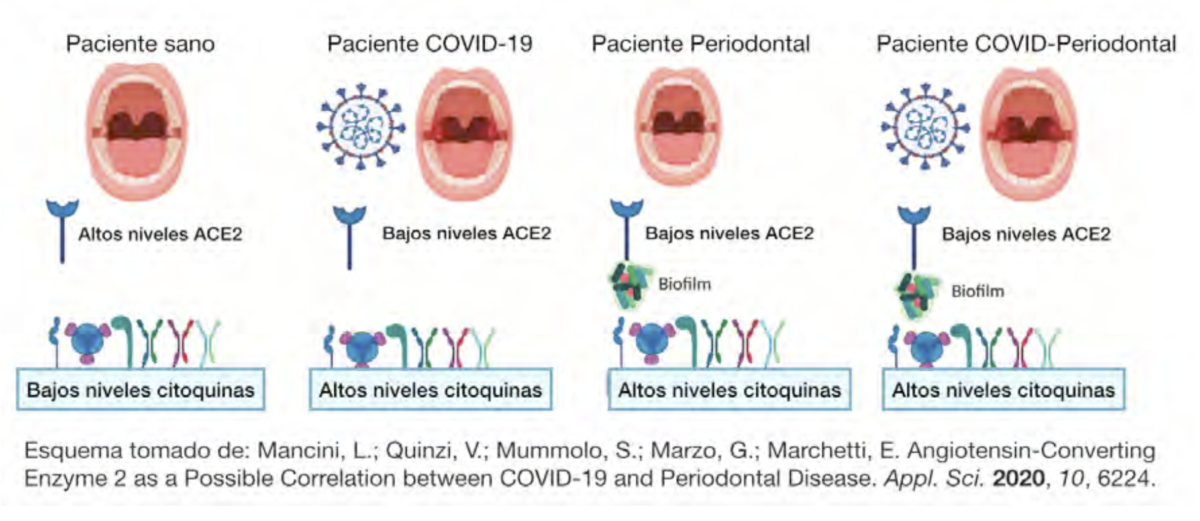
Además, algunas investigaciones sugieren que el virus reconoce el receptor ACE-2, que
está localizado en la nasofaringe, pero también en la mucosa oral29. Por tanto, la entrada del
virus puede subvertir el sistema inmunológico y la microbiota oral del huésped desencadenando
una disbiosis que permite una sobreinfección explicándose la asociación de la EP con la forma
severa de COVID-19. La coinfección de patobiontes y el virus SARS-Cov-2 con factores de riesgo
establecidos y comorbilidades puede desempeñar un papel en el aumento de la respuesta
inflamatoria y la tormenta de citoquinas30.Los receptores ACE2 y TMPRSS2 son los factores
determinantes de la infección por SARS-CoV-2 que se identifican en la cavidad oral. En
particular, se considera que la expresión de estas moléculas en las papilas gustativas permitiría
dilucidar el mecanismo por el cual se manifiestan los síntomas de COVID-19 como los
trastornos del gusto31.
27 Herold T, et al. Level of IL-6 predicts respiratory failure in hospitalized symptomatic COVID-
19 patients. J Allergy Clin Immunol 2020;146(1):128–136.e4. doi: 10.1016/j.jaci.2020.05.008.
28 Viviana Pitones-Rubio, E.G. Chávez-Cortez, Angélica Hurtado-Camarena, Anna González-
Rascón, Nicolás Serafín-Higuera. Is periodontal disease a risk factor for severe COVID-19
illness?, Medical Hypotheses, 2020; 144: https://doi.org/10.1016/j.mehy.2020.109969
29 H. Xu, L. Zhong, J. Deng, J. Peng, H. Dan, X. Zeng, et al.High expression of ACE2 receptor of
2019-nCoV on the epithelial cells of oral mucosa. Int J Oral Sci [Internet]. (2020;12(1)), p. 8
30 F. Jiang L. Deng L. Zhang Y. Cai C.W. Cheung Z. Xia Review of the Clinical Characteristics of
Coronavirus Disease 2019 (COVID-19) J Gen Intern Med [Internet]. 35 5 2020 May 4 1545 1549
Available from http://link.springer.com/10.1007/s11606-020-05762-w
31 W Sakaguchi et al. Existence of SARS-CoV-2 Entry Molecules in the Oral Cavity. Int. J. Mol.
Sci. 2020, 21(17), 6000; https://doi.org/10.3390/ijms21176000
11

Se piensa que las papilas gustativas son las células que influyen en la invasión del SARSCoV-2. La vía de entrada mediada por el receptor-proteasa (TMPRSS2) es importante porque
aumenta la infectividad viral32. La localización de los receptores del huésped y de estas
proteasas es, por tanto, un determinante crítico de la infección viral. Se ha demostrado que los
receptores ACE2 y TMPRSS2 son genes expresados en varios órganos del cuerpo, incluidos
pulmón, corazón, vejiga, páncreas, riñón, piel e intestino delgado33,34 además de la cavidad oral.
El epitelio de la bolsa periodontal está formado por la extensión del epitelio sulcular el cual
coexpresa los receptores ACE2 y TMPRSS2, y dado que la capa celular es fina, existe un alto
riesgo de infección interna. Por lo tanto, se sugiere que el epitelio de la bolsa periodontal puede
ser un punto focal de infección31.
Un aspecto muy relevante que ha sido estudiado recientemente es el comportamiento
del Sistema Angiotensina-Renina (SAR) en pacientes sanos y con periodontitis, en relación a la
COVID-1935. La ACE2 es una enzima identificada en pacientes con enfermedad periodontal en
diferentes tipos de células, como fibroblastos, osteoblastos y osteoclastos, que participan en la
remodelación ósea y de tejidos blandos alrededor de dientes e implantes36. Además, el papel de
esta enzima en respuesta a la aparición y progresión de la enfermedad periodontal está claro. La
posible coexistencia de COVID-19 y periodontitis es una situación crítica. La exacerbación viral
asociada con las bacterias periodontales puede facilitar las infecciones cruzadas y el
reforzamiento mutuo37. La ACE2 está relacionada con el sistema renina-angiotensina (SAR) en el
que tiene un papel indispensable para contrarrestar la función de la ACE. La primera tiene una
función de regulación a la baja, bloqueando el estrés oxidativo, la proliferación celular y la
32 Song, H.; Seddighzadeh, B.; Cooperberg, M.R.; Huang, F.W. Expression of ACE2, the SARS-
CoV-2 Receptor, and TMPRSS2 in Prostate Epithelial Cells. Eur. Urol. 2020, 78, 296–298
33 Bourgonje, A.R.; Abdulle, A.E.; Timens, W.; Hillebrands, J.L.; Navis, G.J.; Gordijn, S.J.; Bolling,
M.C.; Dijkstra, G.; Voors, A.A.; Osterhaus, A.D.; et al. Angiotensin-converting enzyme 2 (ACE2),
SARS-CoV-2 and the pathophysiology of coronavirus disease 2019 (COVID-19). J. Pathol. 2020.
[Google Scholar] [CrossRef] [PubMed]
34 Darbani, B. The Expression and Polymorphism of Entry Machinery for COVID-19 in Human:
Juxtaposing Population Groups, Gender, and Different Tissues. Int. J. Environ. Res. Public
Heal. 2020, 17, 3433. [Google Scholar] [CrossRef]
35 Mancini, L.; Quinzi, V.; Mummolo, S.; Marzo, G.; Marchetti, E. Angiotensin-Converting Enzyme
2 as a Possible Correlation between COVID-19 and Periodontal Disease. Appl. Sci. 2020, 10,
6224.
36 Gabriele,LG; Morandini, A.C.; Dionísio, T.J.; Santos, C.F. Angiotensin II type 1 receptor
knockdown impairs interleukin-1β-induced cytokines in human periodontal fibroblasts. J.
Periodontol. 2017, 88, e1–e11.
37 Patini, R. How to Face the Post-SARS-CoV-2 Outbreak Era in Private Dental Practice: Current
Evidence for Avoiding Cross-infections. J. Int. Soc. Prev. Community Dent. 2020, 10, 237–239.
12
respuesta inflamatoria, mientras que la segunda tiene como objetivo iniciar el proceso
inflamatorio, induciendo la quimiotaxis de células inflamatorias y los mediadores.
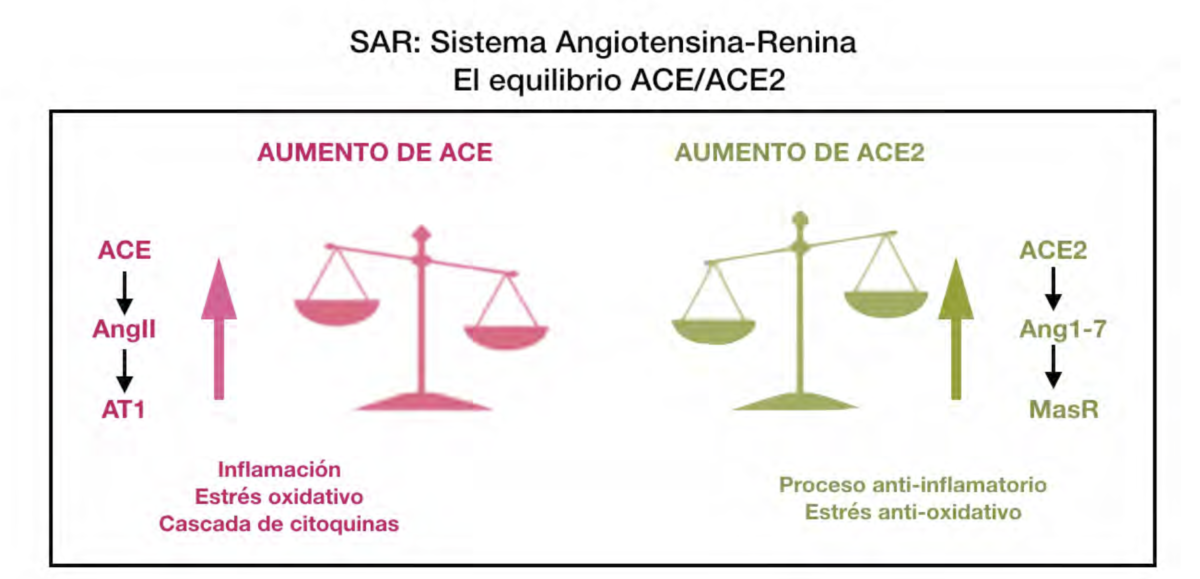
Esquema. Sistema angiotensina-renina (SAR): el rol de la ACE y ACE2.
Durante una coinfección por SARS-CoV-2, el patrón periodontal podría exacerbarse
debido a la regulación a la baja de la ACE2 y un aumento de la ACE y la Ang II, con la
consiguiente participación de varios factores proinflamatorios y el desencadenamiento de la
cascada inflamatoria. Los niveles elevados de ACE2 pueden facilitar la retroalimentación
antiinflamatoria. Por otro lado, niveles más altos de esta proteína pueden facilitar la entrada de
SARS-CoV-2 en la cavidad oral29. El complejo formado entre el virus y las proteínas ACE2
conduce a una nueva reducción de los niveles de ACE2 en el tejido infectado38, lo que puede
desencadenar la expresión de citoquinas. Con las lógicas reservas que exige la prudencia de
más estudios a largo plazo, un aspecto clave a profundizar es la posible predisposición de los
pacientes periodontales a la COVID-19.
38 Sihol F.; Sarlon, G.; Deharo, J.C.; Vaïsse, B. Downregulation of ACE2 induces overstimulation of
the renin-angiotensin system in COVID-19: Should we block the renin-angiotensin
system? Hypertens Res. 2020, in press. [Google Scholar] [CrossRef] [PubMed]
14
En una línea de investigación similar han ido publicándose diferentes estudios que
analizan la posible asociación entre periodontitis y riesgo aumentado de infección por COVID.
Bertolini y cols39 sugieren que, en base a las recientes investigaciones en el campo
periodontal, la terapia periodontal debe considerarse un parámetro de atención en el manejo
clínico global de los pacientes COVID positivos, con el objetivo de reducir el reservorio viral en
las bolsas periodontales porque de esta forma “disminuye la expresión de furina y catepsina L,
reduciendo la capacidad del SARS-CoV-2 para infectar las células huésped”.
Badran y cols40 apuntan a que la infección viral inicial de los tejidos periodontales podría
comenzar por una infección directa o proveniente de la boca o de la membrana basal de las
células a través del torrente sanguíneo o por células inmunes infectadas. La respuesta
inflamatoria continua presente en los sitios afectados por la enfermedad periodontal podría
atraer células mononucleares infectadas por SARS-CoV-2.
La hipótesis está sustentada por los trabajos de Balaji y cols41 basada en el hecho de que
los pacientes que presentan enfermedad periodontal exhiben altos niveles de osteopontina en el
líquido crevicular gingival de sitios con destrucción periodontal, conociéndose que sus
productos de degradación juegan un papel importante para permitir que el SARS-CoV-2 infecte
las células huésped42. El tratamiento periodontal activo podría disminuir la expresión de furina y
catepsina L, reduciendo la capacidad del SARS-CoV-2 para infectar las células huésped39.
Para Kara et al 43 hay suficiente evidencia para apoyar una estrecha relación entre la
gravedad de la periodontitis y las infecciones por Covid-19. Esta relación podría ser causada por
una mayor respuesta inmune mediada por la galectina 3 (Gal-3) y una mayor adhesión viral. En
este contexto, los autores enfatizan la importancia de mantener la enfermedad periodontal bajo
control y de reforzar una higiene bucal rigurosa durante este período de la pandemia de Covid-
19.
__________________________________________________________________________________
______________________________________________________________________________________________
38 Sihol F.; Sarlon, G.; Deharo, J.C.; Vaïsse, B. Downregulation of ACE2 induces overstimulation of
the renin-angiotensin system in COVID-19: Should we block the renin-angiotensin
system? Hypertens Res. 2020, in press. [Google Scholar] [CrossRef] [PubMed]
13
En una línea de investigación similar han ido publicándose diferentes estudios que
analizan la posible asociación entre periodontitis y riesgo aumentado de infección por COVID.
Bertolini y cols39 sugieren que, en base a las recientes investigaciones en el campo
periodontal, la terapia periodontal debe considerarse un parámetro de atención en el manejo
clínico global de los pacientes COVID positivos, con el objetivo de reducir el reservorio viral en
las bolsas periodontales porque de esta forma “disminuye la expresión de furina y catepsina L,
reduciendo la capacidad del SARS-CoV-2 para infectar las células huésped”.
Badran y cols40 apuntan a que la infección viral inicial de los tejidos periodontales podría
comenzar por una infección directa o proveniente de la boca o de la membrana basal de las
células a través del torrente sanguíneo o por células inmunes infectadas. La respuesta
inflamatoria continua presente en los sitios afectados por la enfermedad periodontal podría
atraer células mononucleares infectadas por SARS-CoV-2.
La hipótesis está sustentada por los trabajos de Balaji y cols41 basada en el hecho de que
los pacientes que presentan enfermedad periodontal exhiben altos niveles de osteopontina en el
líquido crevicular gingival de sitios con destrucción periodontal, conociéndose que sus
productos de degradación juegan un papel importante para permitir que el SARS-CoV-2 infecte
las células huésped42. El tratamiento periodontal activo podría disminuir la expresión de furina y
catepsina L, reduciendo la capacidad del SARS-CoV-2 para infectar las células huésped39.
Para Kara et al 43 hay suficiente evidencia para apoyar una estrecha relación entre la
gravedad de la periodontitis y las infecciones por Covid-19. Esta relación podría ser causada por
una mayor respuesta inmune mediada por la galectina 3 (Gal-3) y una mayor adhesión viral. En
este contexto, los autores enfatizan la importancia de mantener la enfermedad periodontal bajo
control y de reforzar una higiene bucal rigurosa durante este período de la pandemia de Covid19.
Muy recientemente, un estudio de casos-control44 muestra que la periodontitis se asocia
con un mayor riesgo de ingreso en la UCI, la necesidad de ventilación asistida y la muerte de los
____________________________
39 Bertolini M, Pita A, Koo S, Cardenas A, Meethil A. Periodontal disease in the COVID-19 era:
potential reservoir and increased risk for SARS–CoV-2. Pesqui Bras Odontopediatria Clín Integr.
2020; 20(supp1):e0134. https://doi.org/10.1590/pboci.2020.162
40 Zahi Badran, Alexis Gaudin, Xavier Struillou, Gilles Amador, Assem Soueidan,
Periodontal pockets: A potential reservoir for SARS-CoV-2?,
Medical Hypotheses, 2020; 143. https://doi.org/10.1016/j.mehy.2020.109907.
41 Madapusi Balaji T, Varadarajan S, Rao USV, Raj AT, Patil S, Arakeri G, et al. Oral cancer and
periodontal disease increase the risk of COVID 19? A mechanism mediated through furin and
cathepsin overexpression. Med Hypotheses 2020; 144:
https://doi.org/10.1016/j.mehy.2020.109936
42 Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, et al. SARS-CoV-2
Cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease
inhibitor. Cell 2020; 181(2):271-280.e8. https://doi.org/10.1016/j.cell.2020.02.052
43 Kara C, Çelen K, Dede FÖ, Gökmenoğlu C, Kara NB. Is periodontal disease a risk factor for
developing severe Covid-19 infection? The potential role of Galectin-3. Experimental Biology
and Medicine. 2020;245(16):1425-1427.
44 Marouf, N., Cai, W., Said, K.N., Daas, H., Diab, H., Chinta, V.R., Hssain, A.A., Nicolau, B., Sanz,
M. and Tamimi, F. (2021), Association between periodontitis and severity of COVID-19 infection:
a case-control study. Journal of Clinical Periodontology. Accepted Author
Manuscript. https://doi.org/10.1111/jcpe.13435
14
pacientes con COVID – 19, así como con un aumento de los niveles sanguíneos de
biomarcadores relacionados con peores resultados de la enfermedad. Para la variable
mortalidad, la OR fue cercana a un valor de 9 (8.8 veces más mortalidad entre aquellos que
presentaban periodontitis severa).
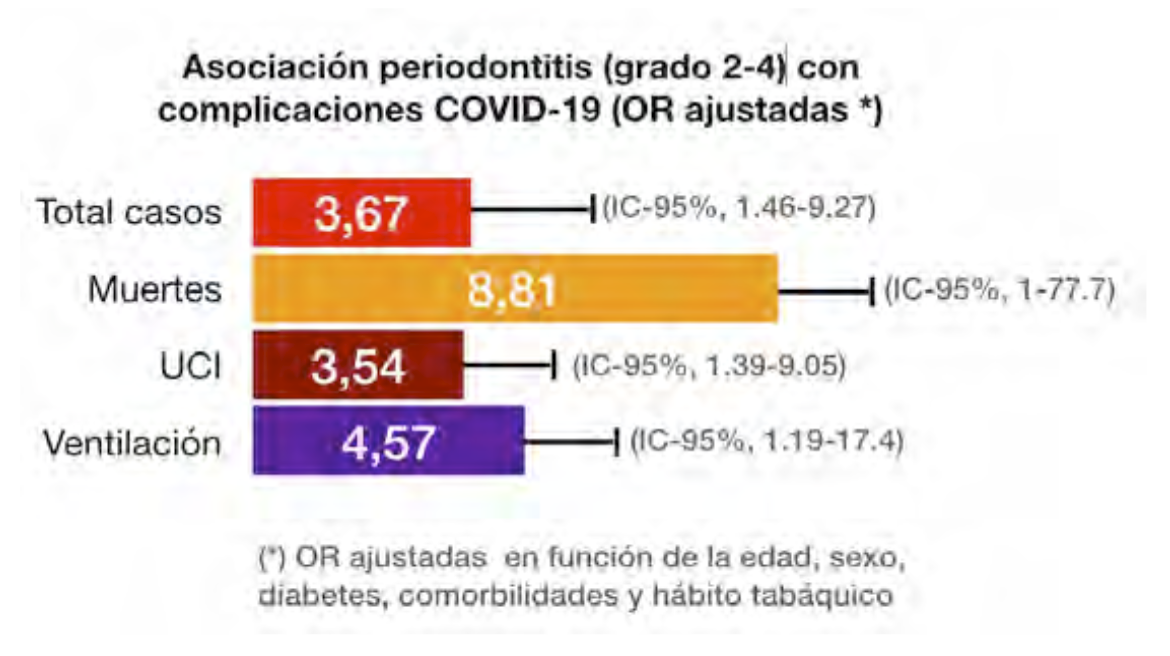
Datos tomados de Marouf, N y col. (cita 44).
Todas estas evidencias llevan a James Wilson, presidente de la Academia Americana de
Periodoncia a solicitar que se añada a la enfermedad periodontal a la lista de factores de riesgo
de la COVID-19 severa45.
En otra área, varios estudios han informado de la relación entre lesiones vesiculares y
aftosas con la COVID-19 46,47. El receptor ACE2, los sitios de unión para el COVID-19, se
expresa abundantemente en la cavidad oral, lo que plantea la cuestión de si la boca es un
objetivo del virus además de serlo de otros órganos como los riñones y los pulmones. La Odds
ratio de COVID-19 en pacientes que presentan estomatitis aftosa recurrente es de 1445. Este
estudio ha demostrado una fuerte asociación entre COVID-19 y estomatitis aftosa recurrente.
Sin embargo, se necesitan estudios longitudinales adicionales.
La hiposalivación ha sido mencionada por algunos48 como factor de riesgo potencial
para la infección por SARS-CoV-2 aludiendo a dos mecanismos: la secreción reducida de saliva
puede dañar la superficie de la mucosa oral como barrera física, lo que en consecuencia mejora
la adhesión y colonización viral; esta reducción también puede afectar la secreción de proteínas
y péptidos antivirales. Sin embargo, y si bien está documentada esta asociación para virus
similares49, son necesarias más investigaciones para confirmar o refutar esta hipótesis.
______________________________________________
45 Wilson J. Presidente de la American Academy of Periodontology. 9 febrero 2021.
https://www.webmd.com/lung/news/20210209/add-gum-disease-to-list-of-risk-factors-for-
severe-covid-19
46 Sinadinos A, Shelswell J. Oral ulceration and blistering in patients with COVID-19. Evid Based
Dent, 2020, 21: 49
47 Katz, J, Yue, S. Increased odds ratio for COVID-19 in patients with recurrent aphthous
stomatitis. J Oral Pathol Med. 2020; 00: 1– 4. https://doi.org/10.1111/jop.13114
48 Farshidfar, N. and Hamedani, S. Hyposalivation as a potential risk for SARS-CoV-2 infection:
Inhibitory role of saliva. Oral Dis.2020; https://doi.org/10.1111/odi.13375
49 Iwabuchi, H., Fujibayashi, T., Yamane, G. Y., Imai, H., & Nakao, H. Relationship between
hyposalivation and acute respiratory infection in dental outpatients. Gerontology, 2012;
58: 205– 211. https://doi.org/10.1159/000333147
15
Parece claro que la boca desempeña un papel fundamental, tanto en lo relativo a la
infección por SARS-CoV-2 como en el pronóstico y posible agravamiento del complejo cuadro
COVID-19. El mayor y mejor estudio de los receptores orales, del sistema angiotensina-renina,
así como de la cascada inflamatoria y su relación con la enfermedad periodontal, está
permitiendo conocer mejor los mecanismos inmunoquímicos y fisiopatológicos de esta conexión
boca-COVID. Obviamente, queda mucho camino por recorrer si se tiene en cuenta el escaso
tiempo transcurrido desde el inicio de esta pandemia. Por ello, y con todas las reservas lógicas
que impone la prudencia científica, el estado oral parece influir en muchos aspectos de la
enfermedad, tanto de manera indirecta evitando complicaciones sistémicas añadidas, como
directamente a través de receptores que pueden modular la unión del virus, su replicación y una
respuesta proinflamatoria indeseable por sus consecuencias en el devenir pronóstico. Se
requieren más estudios clínicos bien diseñados para ir profundizando en este importante
aspecto de la conexión boca-COVID.
MANIFESTACIONES ORALES EN COVID-19
Algunos estudios han encontrado que las disfunciones quimiosensoriales del gusto y el
olfato50,51 pueden ser los primeros y únicos signos de la enfermedad en un porcentaje
considerable de pacientes. Además, estudios más recientes han informado de manifestaciones
clínicas orales en pacientes COVID-19 positivos, incluidas lesiones ulcerativas orales52, lesiones
vesiculobullosas y sialoadenitis aguda53,54,55. La comprensión de las manifestaciones orales de
COVID-19 por parte de los dentistas es extremadamente importante para la detección temprana
de la enfermedad y la prevención de la transmisión. En este apartado se ha intentado de manera
resumida, aportar los datos actualmente disponibles de las posibles manifestaciones orales de
COVID-19, para de esta manera resaltar las implicaciones que tienen para los dentistas.
Nuno González et al56 analizan las manifestaciones mucocutáneas en un grupo de 666
pacientes COVID-19 hospitalizados en España. Se observaron hallazgos en la cavidad oral en el
25.7% de los casos, incluyendo papilitis lingual transitoria (11.5%), glositis (6.6%), estomatitis
aftosa (6.9%) y glositis con depapilación irregular (3.9%).
______________________________
50 Aziz M, Perisetti A, Lee-Smith WM, Gajendran M, Bansal P, Goyal H. Taste changes (dysgeusia)
in Covid-19: a systematic review and metaanalysis. Gastroenterology. 2020 Sep;159(3):1132-
3. https://doi.org/10.1053/j.gastro.2020.05.003
51 Biadsee A, Biadsee A, Kassem F, Dagan O, Masarwa S, Ormianer Z. Olfactory and oral
manifestations of covid-19: sex-related symptoms: a potential pathway to early diagnosis.
Otolaryngol Head Neck Surg. 2020 Oct;163(4):722-
8. https://doi.org/10.1177/0194599820934380
52 Soares CD, Carvalho RA, Carvalho KA, Carvalho mg, Almeida OP. Letter to editor: Oral lesions
in a patient with covid-19. Med Oral Patol Oral Cir Bucal. 2020 Jul 1;25 (4):e563-
4. https://doi.org/10.4317/medoral.24044
53 Ansari R, Gheitani M, Heidari F, Heidari F. Oral cavity lesions as a manifestation of the novel
virus (COVID-19): a letter-to-editor. Oral Dis.
2020;odi.13465. https://doi.org/10.1111/odi.13465
54 Martín Carreras-Presas C, Amaro Sánchez J, López-Sánchez AF, Jané-Salas E, Somacarrera
Pérez ML. Oral vesiculobullous lesions associated with SARS-CoV-2 infection. Oral Dis. 2020
May;odi.13382. https://doi.org/10.1111/odi.13382
55 Putra BE, Adiarto S, Dewayanti SR, Juzar DA. Viral exanthem with “spins and needles
sensation” on extremities of a covid-19 patient: a self-reported case from an indonesian
medical frontliner. Int J Infect Dis. 2020 Jul;96:355-
8. https://doi.org/10.1016/j.ijid.2020.05.020
56 Nuno-Gonzalez A, Martin-Carrillo P, Magaletsky K, Martin Rios MD, Herranz Mañas C, Artigas
Almazán J, García Casasola G, Pérez Castro E, Gallego Arenas A, Mayor Ibarguren A, Feito
Rodríguez M, Lozano Masdemont B, Beato M, Ruiz Bravo E, Oliver P, Montero Vega MD, Herranz
Pinto P. Prevalence of mucocutaneous manifestations in 666 patients with COVID-19 in a field
hospital in Spain: oral and palmoplantar findings. Br J Dermatol. 2021 Jan;184(1):184-185. doi:
10.1111/bjd.19564
17
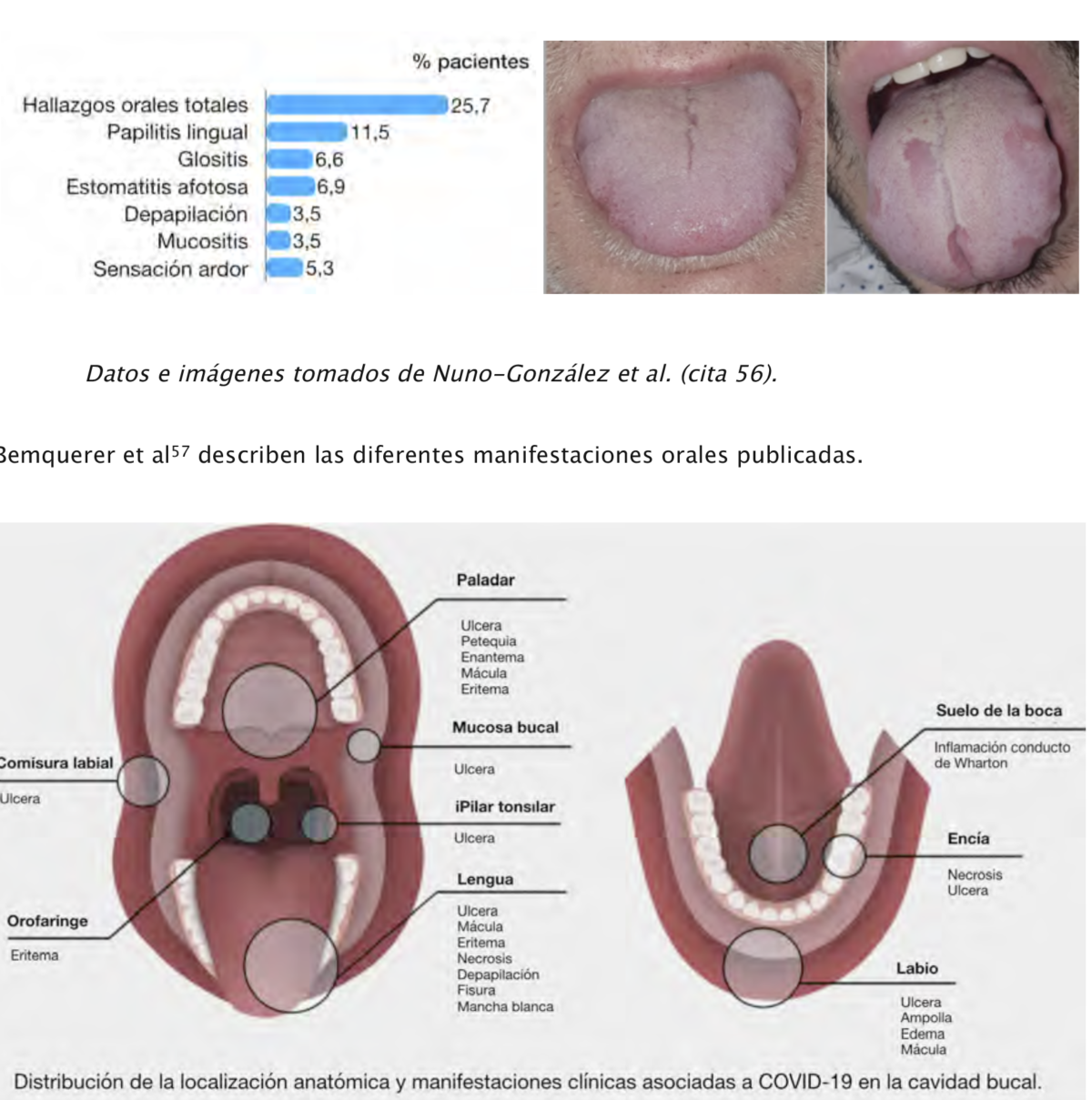
18 Esquema tomado de Bemquerer LM et al (cita 57).
Datos e imágenes tomados de Nuno-González et al. (cita 56).
Bemquerer et al57 describen las diferentes manifestaciones orales publicadas.
En una revisión de la literatura Halboub et al 58 incluyen 16 estudios publicados hasta
octubre del 2020. Todos los casos incluidos tenían confirmación diagnóstica mediante PCR. En
la mayoría de los casos, las manifestaciones orales ocurrieron entre los 3-31 días del inicio de
los síntomas. Las manifestaciones orales fueron muy variables. Las presentaciones más
frecuentes fueron las lesiones ulcerosas, lesiones vesiculobullosas, lesiones eritematosas
maculares y la parotiditis aguda. El sitio más comúnmente afectado fue el paladar duro, seguido
del dorso de la lengua y la mucosa labial.
________________________________________________________
57 Bemquerer, Larissa Marques et al. “The oral cavity cannot be forgotten in the COVID-19 era: Is
there a connection between dermatologic and oral manifestations?.” Journal of the American
Academy of Dermatology, S0190-9622(20)33073-5. 27 Nov. 2020,
doi:10.1016/j.jaad.2020.11.034
58 Halboub E, Al-Maweri S, Alazani RH, Qaid NNM, Abdulrab S. Orofacial manifestations of
COVID-19: A brief review of the published literature. Braz. Oral Res. 2020;34:e124.
https://doi.org/10.1590/1807-3107bor-2020.vol34.0124
18
Las lesiones ulcerosas fueron las manifestaciones orales más comúnmente encontradas.
En cinco estudios, los pacientes presentaron úlceras únicas, mientras que, en algunos casos, los
pacientes presentaron varias pequeñas úlceras dolorosas. Cinco estudios informaron lesiones
vesiculobullosas/maculares orales en pacientes con COVID-19. Las presentaciones clínicas
variaron enormemente, desde ampollas hasta lesiones eritematosas, lesiones petequiales y de
tipo eritema multiforme. La mayoría de los casos con manifestaciones vesiculobullosas /
maculares se asociaron con lesiones cutáneas. Algunos estudios han informado de la presencia
de parotiditis aguda 59,60,61.
En otra revisión sistemática muy reciente62 se incluyeron 40 estudios: 33 transversales y
7 informes de casos. En total, se evaluaron 10,228 pacientes. El deterioro gustativo fue la
manifestación oral más común, con una prevalencia del 45% (IC-95%, 34% a 55%). Los datos para
los diferentes trastornos del gusto fueron 38% para disgeusia y 35% para hipogeusia, mientras
que la ageusia tuvo una prevalencia del 24%. Los trastornos del gusto se asociaron con la
COVID-19 (OR= 12.68; IC-95%, 6.41 a 25.10; p <0,00001), la gravedad leve/moderada
(OR=2.09; IC-95%, 1.25 a 3.49; p = 0,005) y los pacientes del sexo femenino (OR=1.64; IC-
95%, 1.23 a 2,17; p=0,0007).

____________________________________________________
59 Capaccio P, Pignataro L, Corbellino M, Popescu-Dutruit S, Torretta S. Acute parotitis: a
possible precocious clinical manifestation of sars-cov-2 infection? Otolaryngol Head Neck Surg.
2020 Jul;163(1):182-3. https://doi.org/10.1177/0194599820926992
60 Lechien JR, Chetrit A, Chekkoury-Idrissi Y, Distinguin L, Circiu M, Saussez S, et al. Parotitis-
like symptoms associated with covid-19, france, march-april 2020. Emerg Infect Dis. 2020
Sep;26(9):26. https://doi.org/10.3201/eid2609.202059
61 Fisher J, Monette DL, Patel KR, Kelley BP, Kennedy M. COVID-19 associated parotitis: a case
report. Am J Emerg Med. 2020 Jun;S0735-6757(20)30549-0
https://doi.org/10.1016/j.ajem.2020.06.059
62 Amorim Dos Santos J, Normando AGC, Carvalho da Silva RL, Acevedo AC, De Luca Canto G,
Sugaya N, Santos-Silva AR, Guerra ENS. Oral Manifestations in Patients with COVID-19: A Living
Systematic Review. J Dent Res. 2021 Feb;100(2):141-154. doi: 10.1177/0022034520957289.
19
BOCA: TEST Y VACUNAS
La posible utilidad de la cavidad oral, tanto para el diagnóstico de COVID-19 como para
hipotética vía de administración de vacunas, también está siendo analizada.
Una revisión sistemática acompañada de metaanálisis63, en base a 16 estudios
independientes y en 5.900 pacientes, muestra que la sensibilidad combinada de muestras en
saliva fue del 83.2% (IC-95%, 74.7% -91.4%) y la especificidad combinada fue del 99.2% (IC-95%,
98.2% -99.8%). El hisopo nasofaríngeo tuvo una sensibilidad del 84.8% (IC-95%, 76.8% -92.4%) y
una especificidad del 98.9% (IC-95%, 97.4% -99.8%). Estos resultados sugieren que la precisión
del diagnóstico de muestra en saliva es similar a la obtenida con hisopo nasofaríngeo,
especialmente en el entorno ambulatorio. Estos resultados han sido confirmados recientemente
en otra revisión sistemática64 pero los aspectos más destacados de esta revisión son la
heterogeneidad y las deficiencias metodológicas en los estudios primarios. Por ello los autores
recomiendan mejorar los diseños para poder generar niveles más altos de evidencia.
Los hisopos nasofaríngeos son el método de muestreo principal que se utiliza para la
detección del síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2), pero requieren
de profesional sanitario capacitado y un amplio equipo de protección personal. Una reciente
revisión sistemática y metaanálisis65 que incluye 37 estudios independientes, muestra que la
saliva presenta una sensibilidad de 3.4 puntos porcentuales más baja que la de los hisopos
nasofaríngeos. Entre las personas con infección por SARS-CoV-2 previamente confirmada, la
sensibilidad de la saliva fue 1,5 puntos porcentuales más alta que la de los hisopos
nasofaríngeos. Entre las personas sin un diagnóstico previo de SARS-CoV-2, la saliva fue 7.9
puntos porcentuales menos sensible (IC-95%, 14.7 puntos porcentuales menos a 0.8 puntos
porcentuales más). En este subgrupo, si se analizan 100 000 personas con una prevalencia de
SARS-CoV-2 del 1%, los hisopos nasofaríngeos detectarían 79 personas más que con muestra de
saliva, pero con un costo adicional por cada infección adicional detectada de 8093$. La revisión
sistemática concluye que las muestras de saliva parecen ser una alternativa con una sensibilidad
similar y menos costosa que podrían reemplazar a los hisopos nasofaríngeos para la
recolección de muestras clínicas en las pruebas de diagnóstico SARS-CoV-2.
Finalmente, la mucosa oral está siendo estudiada como posible candidata de vacunas
anti- SARS-CoV-2 de administración oral, con la esperanza de poder potenciar la inmunidad
frente a la COVID-1966. La idea es desarrollar vacunas con antígenos específicos, adyuvante
mucoso y excipientes muco-adhesivos, que puedan ser eficaces, bien administradas por vía de
mucosa nasal u oral, sirviéndose de la experiencia previa adquirida con vacunas mucosas.
_______________________________________________________
63 Butler-Laporte G, Lawandi A, Schiller I, et al. Comparison of Saliva and Nasopharyngeal Swab
Nucleic Acid Amplification Testing for Detection of SARS-CoV-2: A Systematic Review and Meta-
analysis. JAMA Intern Med. Published online January 15, 2021.
doi:10.1001/jamainternmed.2020.8876
64 Kapoor, P., Chowdhry, A., Kharbanda, O.P. et al. Exploring salivary diagnostics in COVID-19: a
scoping review and research suggestions. BDJ Open 7, 8 (2021).
https://doi.org/10.1038/s41405-021-00064-7
65 Bastos ML, Perlman-Arrow S, Menzies D, Campbell JR. The Sensitivity and Costs of Testing for
SARS-CoV-2 Infection With Saliva Versus Nasopharyngeal Swabs: A Systematic Review and Meta-
analysis. Ann Intern Med. 2021 Jan 12. doi: 10.7326/M20-6569.
66 Leticia Moreno-Fierros, Ileana García-Silva & Sergio Rosales-Mendoza. Development of SARS-
CoV-2 vaccines: should we focus on mucosal immunity?, Expert Opinion on Biological
Therapy, 2020; 20:8, 831-836, DOI: 10.1080/14712598.2020.1767062
20
ensayadas frente al SARS-CoV1 y el MERS-CoV67 . La existencia de vacunas administradas a
través de la mucosa oral frente a otros patógenos respiratorios (influenza, tuberculosis) con
resultados incluso superiores a las alternativas parenterales, permite ser optimista y explorar
esta vía. La inmunización oral también es un enfoque muy atractivo en términos de simplicidad
de administración; evitando dispositivos estériles, logística compleja, la necesidad de personal
capacitado y el dolor durante la administración. Además, la inmunización oral tiene la capacidad
de producir respuestas inmunes robustas en la mucosa del tracto respiratorio68.
Un esfuerzo mundial concertado ha dado lugar a más de 150 vacunas actualmente en
desarrollo. Sin embargo, la administración por vía oral se ha subestimado como posible
estrategia inmunológica potencialmente eficaz69. La investigación actual ha revelado una alta
expresión del receptor del SARS-CoV-2, ACE2, y la serina proteasa en enterocitos del íleon y el
colon70. Esto destaca una ruta de invasión del huésped por parte del SARS-CoV-2, y un sitio
potencial en el que, la inducción inmunitaria artificial a través de una vacuna oral podría ser
protectora.
Se pueden obtener varios beneficios mediante el empleo de un enfoque de
administración oral. La evidencia sugiere que la vía mucosa puede permitir una inducción más
potente de respuestas inmunitarias humorales (mediadas por anticuerpos) y celulares, para
responder de manera efectiva a los desafíos respiratorios71.6 Además, como se ha documentado
con las vacunas orales contra la poliomielitis y el rotavirus, la eliminación fecal de las vacunas
orales puede acelerar la inmunidad colectiva evitando la transmisión oro-fecal en contactos
cercanos, particularmente en los países en vía de desarrollo72.
Las vacunas orales también se pueden fabricar de manera más simple, lo que resalta la
importancia de este enfoque73. La facilidad de la inoculación oral también elimina el requisito de
que estén presentes profesionales de la salud capacitados para administrar la vacuna, lo que
potencialmente maximiza la aceptación y el grado de cumplimiento. Esto además amplía
significativamente las opciones prácticas para la distribución de vacunas, particularmente en
entornos con recursos limitados que son los más afectados, dado que otras medidas preventivas
________________________________________________________________
67 Wang N, Shang J, Jiang S, et al. Subunit vaccines against emerging pathogenic human
coronaviruses. Front Microbiol. 2020;11:298.
68 Samuelson DR, Welsh DA, Shellito JE. Regulation of lung immunity and host defense by the
intestinal microbiota. Front Microbiol. 2015; 6:1085.
69 Mehan A, Venkatesh A, Girish M. COVID-19: should oral vaccination strategies be given more
consideration?. Ther Adv Vaccines Immunother. 2020;8:2515135520946503. Published 2020 Jul
27. doi:10.1177/2515135520946503
70 Zhang H, Kang Z, Gong H, et al. Digestive system is a potential route of COVID-19: an analysis
of single-cell coexpression pattern of key proteins in viral entry process. Gut 2020; 69: 1010–
1018.
71 Goffin E, Javaux J, Destexhe E, et al. Oral vaccination with replication-competent adenovirus in
mice reveals dissemination of the viral vaccine beyond the gastrointestinal tract. J
Virol 2019; 93(13): e00237–19
72 Li JS, Cao B, Gao HC, et al. Faecal shedding of rotavirus vaccine in Chinese children after
vaccination with Lanzhou lamb rotavirus vaccine. Sci Rep 2018; 8: 1–7.
73 Ramirez JE, Sharpe LA, Peppas NA. Current state and challenges in developing oral
vaccines. Adv Drug Deliv Rev 2017; 114: 116–131.
21
como el distanciamiento social, pueden ser más difíciles de implementar74. Además, las
formulaciones orales térmicamente estables permitirían prescindir de una cadena de suministro
con temperatura controlada, lo que podría simplificar aún más la logística de distribución al
eliminar un componente significativo del coste en los programas de distribución de vacunas75.
En la actualidad algunas compañías farmacéuticas han iniciado ensayos clínicos con
vacunas orales (como es el caso de InmmunityBio® o Vaxart® entre otras), encontrándose en
fase 1.
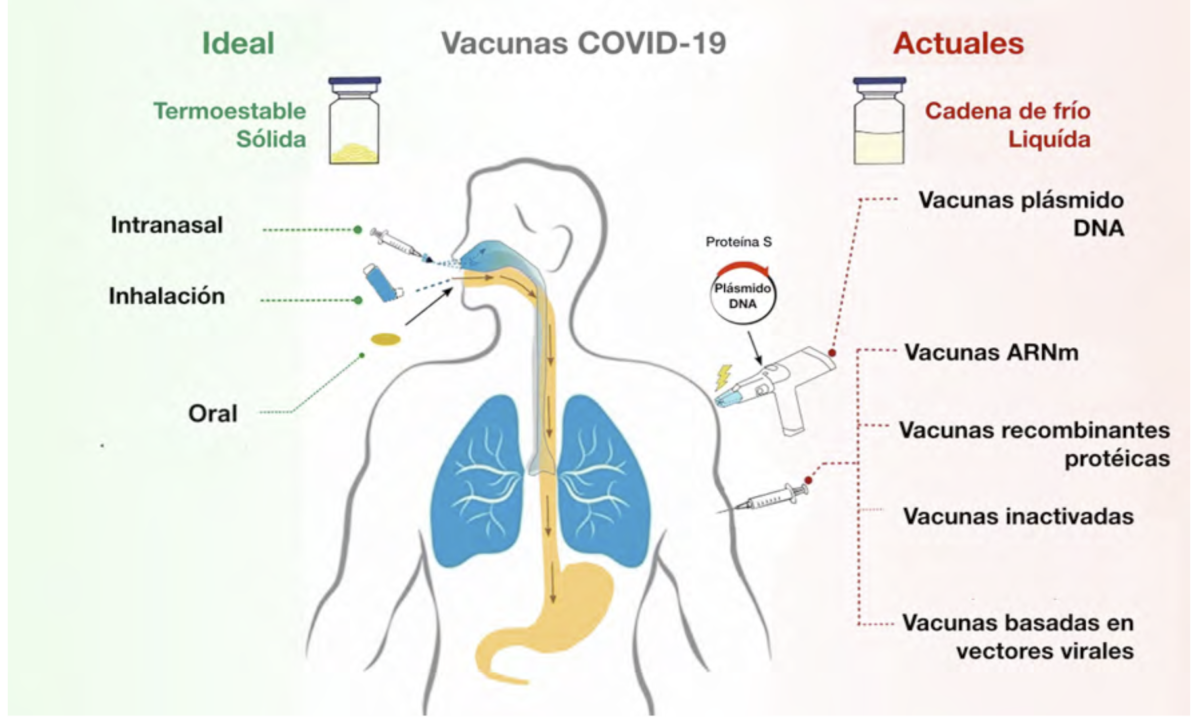
Esquema: Una comparación de las vías de administración entre las vacunas ideales y las actuales
candidatas a la vacuna COVID-19. Tomado de Wang76.
74 Gibson L, Rush D. Novel coronavirus in Cape Town informal settlements: feasibility of using
informal dwelling outlines to identify high risk areas for COVID-19 transmission from a social
distancing perspective. JMIR Public Health Surveill 2020; 6: e18844.
75 Isanaka S, Guindo O, Langendorf C, et al. Efficacy of a low-cost, heat-stable oral rotavirus
vaccine in Niger. N Engl J Med 2017; 376: 1121–1130.
76 Wang, J., Peng, Y., Xu, H. et al. The COVID-19 Vaccine Race: Challenges and Opportunities in
Vaccine Formulation. AAPS PharmSciTech 21, 225 (2020). https://doi.org/10.1208/s12249-
020-01744-7

